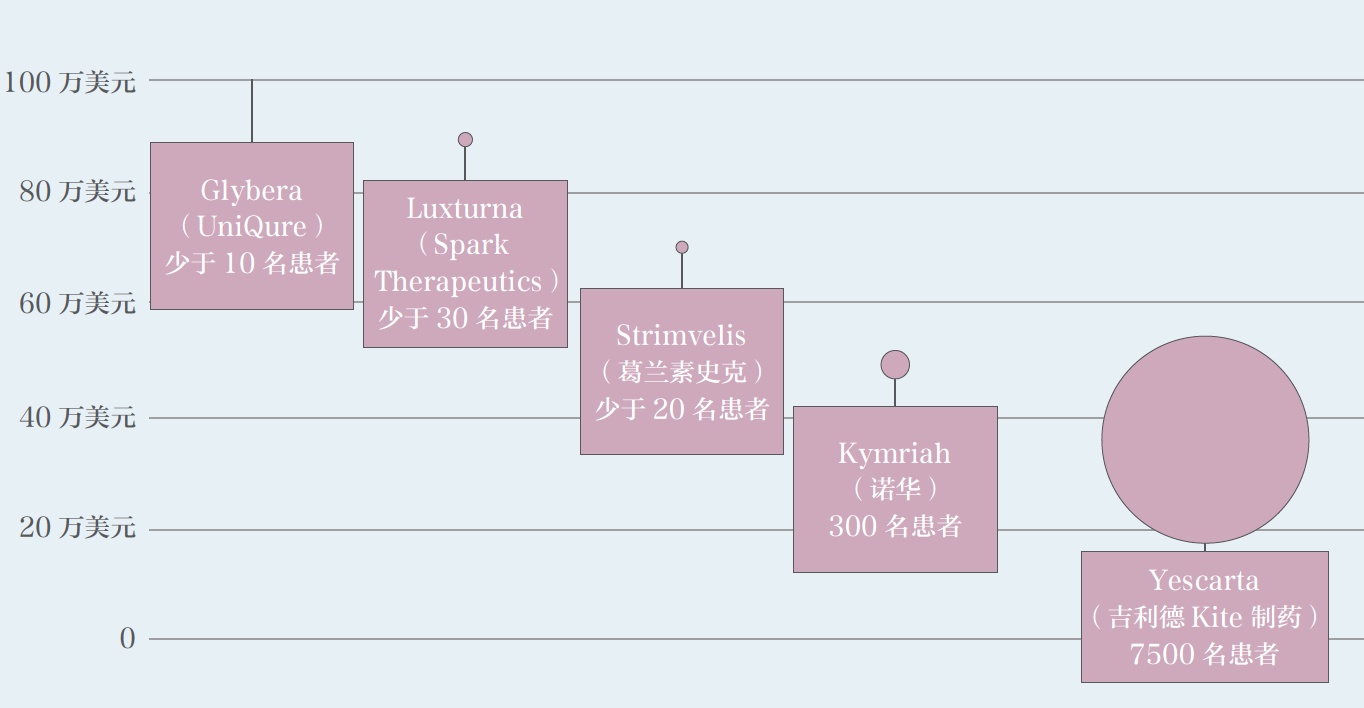
其实这个价格并不高。在美国,干细胞移植都要花100万美元,一款基因疗法提供的效果保守来说也跟干细胞移植差不多,所以200多万的价格并不是太高。第一款在美国上市的基因疗法luxturna价格是两只眼睛85万美元。以后上市的基因疗法药物也会在100万到300万的区间。
如下图所示,基因疗法药物的价格与患者人数呈相关,人数越少,价格越高。毕竟研发一种药物的成本大体上在一个区间,患者人数越少,分摊到每个病人的价格只能越高才可以收回成本。基因治疗目前主攻的就是罕见遗传病,所以价格高是有其道理的。
但是这是美国医保系统前提下的价格,在中国如果上市,价格不能简单乘以汇率。毕竟在美国,一个普通骨折账单上几万美元很正常。基因疗法在中国的价格是多少很难说,毕竟中国连罕见病定义都没有,更没有纳入医保,定价上千万人民币没有太大意义。真有这钱的人去美国治疗不就完了。
世界上第一款基因疗法glybera在欧洲上市,定价100多万美元,最后因为保险公司不愿意支付,最后有价无市,只卖出一份不得不下市收场。显然,后来的luxturna吸取了这一教训。luxturna是治疗先天性眼疾黑蒙的基因疗法,据悉接受治疗的患者视力大幅提升,甚至已经拿到了驾照。在定价上,luxturna采用了以下策略。
根据效果收费
创新的销售模式
分期付款
 luxturna采用直销的模式,而不是由医院代理,这样避免了‘中间商赚差价’。这一措施可能让价格降低了50%之多。zolgensma有可能也采用了类似的定价策略,才让原本预期400到500万美元的价格降至200多万美元。
luxturna采用直销的模式,而不是由医院代理,这样避免了‘中间商赚差价’。这一措施可能让价格降低了50%之多。zolgensma有可能也采用了类似的定价策略,才让原本预期400到500万美元的价格降至200多万美元。
关于效果,因为zolgensma用aav病毒载体而不是基因编辑,我个人对其疗效的持久度持保留态度。因为aav病毒载体不会随细胞分裂而复制到下一个细胞,也就是说细胞分裂一次,aav载体就稀释一次,理论上,aav基因疗法无法提供终身疗效。当然,现在的临床试验(一般跟踪3到5年)也没办法测试zolgensma更长期的疗效。所以,请不要以为基因疗法就等于一针治愈,疗效持续终身。
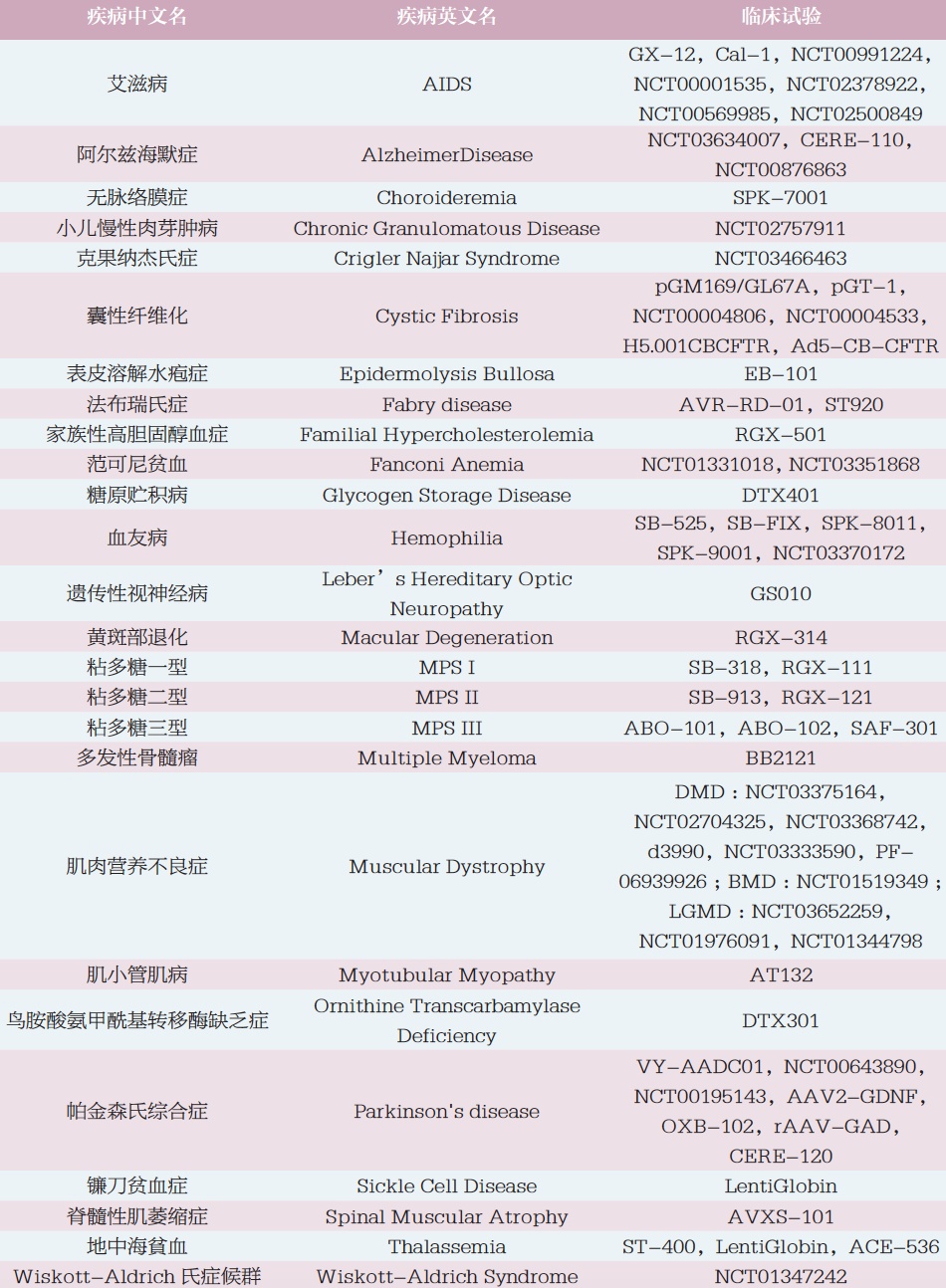
另外,我整理了下目前关注度比较高的遗传病基因治疗临床试验,下一款上市的基因疗法药物应该就在此之中。有兴趣的朋友可以关注下。
 PS: 如果您想为罕见病患者做点事情请私信我,让我们看看能一起做点什么。
PS: 如果您想为罕见病患者做点事情请私信我,让我们看看能一起做点什么。
每篇相关回答和文章下面我都会写上这么一句,而且真的有很多患者联系我,虽然我能帮到的也不多。最让我感动的是许多单纯想为罕见病患者做些事情的热心人,谢谢你们,让我觉得黑暗中还有希望。
references:
Ou L, DeKelver R, Rhode M, Tom S, Radeke R, St Martin SJ, Santiago Y, Sproul S, Przybilla MJ, Koniar BL, Podetz-Pedersen KM, Laoharawee K, Cooksley RD, Meyer KE, Holmes MC, McIvor RS, Wechsler T, Whitley CB. ZFN-mediated in vivo genome editing corrects murine Hurler syndrome. Mol Ther. 2019 Jan 2;27(1):178-187.Laoharawee K, DeKelver R, Podetz-Petersen KM, Rohde M, Sproul S, Nguyen HO, Nguyen T, St Martin S, Ou L, Tom S, Radeke R, Meyer KE, Holmes MC, Whitley CB, Wechsler T, McIvor RS. Dose-dependent IDS expression and prevention of metabolic and neurologic disease in a mouse model of Hunter Syndrome by ZFN-mediated in vivo genome editing. Mol Ther. 2018. 26 (4), 1127-1136.
|